اسید فرمیک
|
فرمیک اسید یا متانوئیک اسید ، سادهترین عضو گروه کربوکسیلیک اسیدها میباشد. فرمول شیمیایی آن HCOOH بوده و در طبیعت در نیش حشراتی مانند مورچه و زنبور یافت میشود. همچنین ترکیب عمده ماده گزشزا در برگ گزنه میباشد. ریشه لغوی فرمیک اسید از نام لاتینی مورچه ( Formica) گرفته شده است. زیرا این ترکیب اولین بار از تقطیر تخریبی مورچه بدست آمد. |
تاریخچه
در قرن 15 شیمیدانها و دانشمندان علوم طبیعی میدانستند که از تجمع مورچهها بخارهای اسیدی متصاعد میشود. اولین بار "جان ری" طبیعت شناس انگلیسی در سال 1671 این اسید را از تقطیر تودهای از مورچههای مرده ، جدا کرد. اما سنتز شیمیایی آن ، اولین بار توسط شیمیدان فرانسوی "ژوزف گیلوساک" از اسید هیدروسیانیک انجام گرفت. در سال 1855 شیمیدان فرانسوی دیگری به نام "Marcellin berthelot" اسید فرمیک را با استفاده از منوکسید کربن سنتز کرد، شبیه روشی که امروزه مورد استفاده قرار میگیرد.
خواص عمومی اسید
اسید فرمیک بهخوبی با آب و بیشتر حلالهای آلی قطبی مخلوط میشود. در هیدروکربنها هم تا حدی حل میشود. اسید فرمیک در فاز گازی و در هیدروکرینها بهصورت دیمرهایی است که با پیوند هیدروژنی به هم متصل شدهاند. در فاز گازی پیوند هیدروژنی میان مولکولهای اسید فرمیک باعث انحراف از قانون گازهای ایدهآل میشود. اسید فرمیک در حالت مایع و جامد شامل شبکهای نامحدود از مولکولهایی است که با پیوند هیدروژنی به هم متصل هستند. بیشتر خواص اسید فرمیک همانند خواص سایر اسیدهای کربوکسیلیک میباشد، اما آن نمیتواند آسیل کلرید ایجاد کند.
در صورت تشکیل هریک ازاین ترکیبات ، تجزیه شده و منوکسید کربن ایجاد میکنند. حرارت دادن اسید فرمیک باعث تجزیه آن بر Co میشود. اسید فرمیک بهآسانی احیاء شده و به فرمالدئید تبدیل میشود. اسید فرمیک تنها کربوکسیلیک اسیدی است که توانایی شرکت در واکنشهای افزایشی را به همراه آلکنها دارد. اسید فرمیک و آلکنها بهآسانی باهم واکنش داده و استرهای فرمات ایجاد میکنند. اسید فرمیک در حضور اسید سولفوریک و هیدروفلوئوریک اسید ، در واکنش کخ شرکت کرده و اسیدهای کربوکسیلیک بزرگتر ایجاد میکند.
خواص فیزیکی اسید فرمیک
|
نام آیوپاک |
نام متداول |
فرمول شیمیایی |
وزن مولکولی |
دمای ذوب |
دمای جوش |
PKa | |
|
متانوئیک اسید |
اسیدفرمیک |
HCOOH |
46.03 |
8.4° |
100.8° |
1.22gr/Cm3 |
3.75 |
روش تولید
در صنعت تولید ترکیبات شیمیایی ، فرمیک اسید به مدت طولانی بهعنوان ترکیبی که بهرهوری کمتری را داراست، تلقی میشد. قسمت عمده اسید فرمیک بهعنوان محصول فرعی در تولید سایر ترکیبات شیمیایی ، مخصوصا اسید استیک تولید میشود. اما با روند رو به رشد استفاده آن در مواد نگهدارنده و آنتی باکتریال در غذای دام ، امروزه در صنعت به این منظور تولید میشود.
وقتی متانول و منوکسید کربن در حضور یک باز قوی مانند منوکسید سدیم باهم واکنش میدهند، مشتقی از اسید فرمیک به نام متیل فرمات تولید میشود. این واکنش در فاز مایع در دمای درجه سانتیگراد و فشار 40atm انجام میشود. از هیدرولیز متیل فرمات ، اسید فرمیک ایجاد میشود.
|
|
|
زوایای پیوندی در اسید فرمیک |
کاربرد ویژه
اسید فرمیک بیشتر بهعنوان نگهدارنده (جلوگیری از فاسد شدن) و آنتی باکتریال در غذای دام استفاده میشود. پاشیدن مقداری از آن روی علف تازه خشک شده از فساد و پوسیدگی آن جلوگیری کرده و مواد مغذی آن را تا حد بالایی حفظ میکند. برای جلوگیری از فساد غذای زمستانی دامها در مجتمعهای بزرگ دامداری از این ماده استفاده میشود.
اسید فرمیک در مرغداریها برای از بین بردن باکتری سالمونلا به غذای مرغها اضافه میشود. این ترکیب همچنین به مقدار ناچیز در صنعت نساجی و دباغی استفاده میشود. برخی از مشتقات آن مانند استرهای فرمات در صنعت خوشبوکنندهها مورد استفاده قرار میگیرند.
ایمنی
بیشترین خطر فرمیک اسید در تماس پوست یا چشم با مایع یا بخار غلیظ آن میباشد. تماس پوست با مایع یا بخار آن باعث سوختگی شیمیایی و در صورت تماس با چشم ممکن است باعث ایجاد آسیبهای دائمی در چشم شود. تنفس بخار آن موجب تحریک و سوزش دستگاه نفسی میشود. از آنجا که ممکن است مقادیری CO در بخار اسید فرمیک موجود باشد، باید در نگهداری ، حمل و نقل و استفاده از آن ، نکات ایمنی کاملا رعایت شود.
سازمان غذا و داروی آمریکا مقدار مجاز ، بخار اسید فرمیک در هوای محیط کار را 5ppm اعلام کرده است. اسید فرمیک بهآسانی متابولیزه شده و از بدن دفع میشود. اما با این همه قرار گرفتن مداوم در معرض آن باعث ایجاد عوارض مزمن مثل ایجاد حساسیتهای پوستی میشود. آزمایش روی حیوانات آزمایشگاهی نشان میدهد که قرار گرفتن طولانی در معرض اسید فرمیک باعث ایجاد جهش ژنی و آسیبهای کلیوی و کبدی میشود.
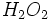 و 20 درصد وزنی
و 20 درصد وزنی 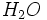 به همراه
به همراه  تعیین میشود
تعیین میشود